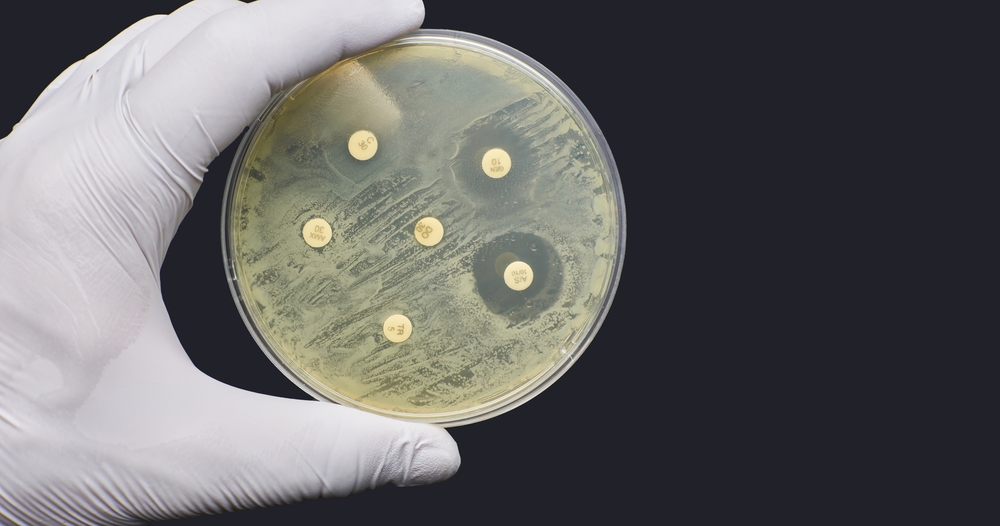
Исследователи Массачусетского технологического института использовали модели глубокого обучения для открытия первого за последние десятилетия нового класса антибиотиков. Полученные антибиотики могут переломить ход борьбы с лекарственно-устойчивыми бактериями.
Когда Александр Флеминг открыл пенициллин, первый в мире антибиотик, он знал о связанных с ним опасностях.
В своей речи о присуждении Нобелевской премии в 1945 году Флеминг сказал: "Затем существует опасность, что невежественный человек может легко передозировать себя и, подвергая свои микробы воздействию несмертельных количеств лекарства, сделать их устойчивыми".
По мере разработки новых антибиотиков их неправильное назначение приводило к тому, что бактерии, на которые они были направлены, постепенно становились устойчивыми к этим ранее эффективным лекарствам.
Команда, которую возглавляет доктор Джим Коллинз в Лаборатория Коллинза Для решения этой проблемы в 2020 году в Массачусетском технологическом институте был запущен проект "Антибиотики-АИ". Проект рассчитан на семь лет и предполагает разработку семи новых классов антибиотиков для лечения семи самых опасных бактериальных патогенов в мире.
Их усилия по использованию машинного обучения начали приносить свои плоды. их газета объявили об открытии нового класса антибиотиков, способных убивать метициллин-резистентный золотистый стафилококк (MRSA). Только в США от инфекций MRSA, устойчивых к лекарствам, ежегодно умирает до 10 000 человек.
Фармацевтические компании не направляют значительную часть своих исследований на антибиотики, потому что это не так прибыльно, как другие лекарства. Кроме того, открывать новые антибиотики становится все сложнее. ИИ только что сделал это намного проще.
Модели глубокого обучения
Сложность создания нового антибиотика заключается в том, что существует почти бесконечное множество молекулярных схем, и трудно определить, какая из них убьет конкретную бактерию. Кроме того, исследователям необходимо убедиться, что новое соединение не убивает здоровые клетки.
Команда Массачусетского технологического института создала базу данных из 39 000 различных соединений и их воздействия на золотистый стафилококк. Они также проанализировали цитотоксичность соединений, отследив их воздействие на клетки печени, скелетных мышц и легких человека.
В набор данных также была добавлена информация о химической структуре соединений, которая затем была использована для обучения модели искусственного интеллекта с глубоким обучением.
На основе большого набора данных модель смогла узнать, какие химические структуры с наибольшей вероятностью уничтожат бактерии, избежав при этом негативного воздействия на здоровые клетки.
После обучения модель искусственного интеллекта была использована для проверки 12 миллионов коммерчески доступных соединений. Модель выявила молекулы из пяти различных классов, которые, по ее прогнозам, должны были убить бактерию MRSA.
На основе этого значительно суженного списка соединений-кандидатов исследователи получили 280 соединений для тестирования против бактерий MRSA, выращенных в лабораторной посуде. В результате испытаний было обнаружено, что два соединения уменьшают количество MRSA в 10 раз.
Объяснимый искусственный интеллект
Модели ИИ часто дают нам полезные ответы, но они могут быть непостижимыми черными ящиками, не позволяющими понять, как они пришли к такому ответу.
Феликс Вонг, постдок из Массачусетского технологического института и Гарварда и один из ведущих авторов исследования вместе с Эрикой Чжэн, сказал: "В этом исследовании мы поставили перед собой задачу открыть "черный ящик". Эти модели состоят из очень большого количества вычислений, которые имитируют нейронные связи, и никто на самом деле не знает, что происходит под капотом".
Понимание того, что заставило модель выбрать именно те соединения, которые она выбрала, позволит исследователям лучше понять, где искать более эффективные лекарства. Исследовательская группа использовала адаптированный алгоритм древовидного поиска Монте-Карло, чтобы получить представление о процессе принятия решений моделью глубокого обучения.
Доктор Коллинз объяснил: "Мы можем увидеть, что именно модели изучают, чтобы сделать свои предсказания о том, что определенные молекулы могут стать хорошими антибиотиками".
Наряду с Массачусетским технологическим институтом, в исследовании приняли участие Институт Броуда, Integrated Biosciences, Институт биологической инженерии Уисса и Институт Лейбница по исследованию полимеров в Дрездене (Германия).
Использование искусственного интеллекта для отбора миллионов потенциальных химических соединений оказывает огромное влияние на открытие лекарств. Лаборатория Коллинза работает по принципу "один минус, шесть плюсов", и похоже, что у их семилетнего проекта еще есть время.