Forskare vid Johns Hopkins Kimmel Cancer Center utvecklar en ny blodprovsteknik som kallas GEMINI (Genome-wide Mutational Incidence for Non-Invasive detection of cancer).
Genom att kombinera genomomfattande sekvensering av enskilda DNA-molekyler som tumörer gör sig av med maskininlärning (ML) kan testet möjliggöra tidigare upptäckt av lungcancer och andra cancerformer.
GEMINI-testet analyserar fragment av cellfritt DNA (cfDNA) som utsöndras av tumörer och använder ML för att upptäcka skillnader i mutationsfrekvenser för cancer och icke-cancer i hela genomet. Högre poäng som genereras av modellen tyder på en högre sannolikhet för att ha cancer.
I laboratorietester användes GEMINI på datortomografibilder och upptäckte över 90% lungcancer, även i tidiga stadier. Den studie resultaten publicerades i Nature Genetics.
Forskarna fokuserade främst på att upptäcka lungcancer hos högriskpopulationer.
Förändrade mutationsprofiler observerades dock även i cfDNA från patienter med levercancer, melanom och lymfom, så denna metod skulle kunna användas för olika typer av cancer.
Hur forskarna skapade GEMINI
För att utveckla GEMINI studerade teamet genomsekvenser från 2.511 individer med 25 olika cancerformer.
Olika tumörtyper hade olika mutationsprofiler. Forskarna fann att genomiska regioner med hög mutationsfrekvens var likartade mellan tumörvävnad och blodderiverat cfDNA hos patienter med lungcancer, melanom eller B-cells non-Hodgkin lymfom.
GEMINI-testet tillämpades sedan på cfDNA från 365 personer med hög risk för lungcancer, vilket gav högre poäng hos personer med cancer än hos dem utan.
Forskarna undersökte också integreringen av GEMINI med ett tidigare test som kallas DELFI (DNA evaluation of fragments for early interception),
Totalt identifierade GEMINI och DELFI cancersjukdomar korrekt 91% av gångerna i 89 prover.
Anmärkningsvärt är att GEMINI-testet upptäckte avvikelser i cfDNA-mutationsprofiler flera år före standarddiagnoser hos sju patienter som inte hade några påvisbara tumörer vid blodprovstagningen.
Sex personer testade positivt med GEMINI och fick senare diagnosen lungcancer mellan 231 och 1.868 dagar efter att proverna togs.
Fördelning av studien
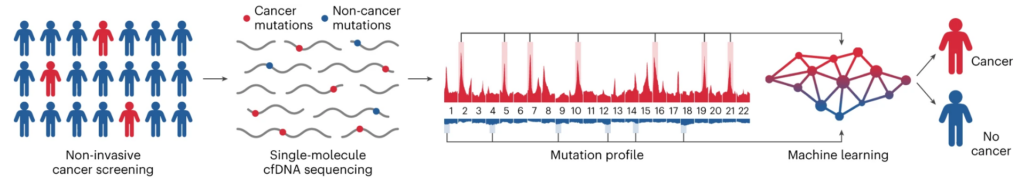
- Blodprovstagning: Ett blodprov tas från en person som kan vara i riskzonen för att utveckla cancer. Detta prov innehåller cfDNA, små fragment av DNA som har utsöndrats av celler i kroppen, inklusive eventuella tumörceller.
- DNA-extraktion och sekvensering: cfDNA extraheras från blodprovet och sekvensbestäms sedan. Det innebär att forskarna kartlägger ordningen på de "byggstenar" som DNA består av. Detta hjälper dem att identifiera eventuella förändringar eller mutationer i DNA:t.
- Analys av DNA-förändringar: Varje enskild DNA-molekyl analyseras med avseende på eventuella sekvensförändringar, vilket gör det möjligt för forskarna att kartlägga mutationsprofiler över hela genomet. I själva verket letar de efter mönster i mutationerna som kan tyda på förekomst av cancer.
- Maskininlärning: En maskininlärningsmodell, som har tränats för att känna igen skillnaden mellan cancerframkallande och icke-cancerframkallande mutationsfrekvenser i olika delar av genomet, används sedan för att analysera mutationsprofilerna. Maskininlärningsmodellen ger sedan en poäng som sträcker sig från 0 till 1, där en högre poäng indikerar en högre sannolikhet för cancer.
- Ytterligare validering och testning: Om GEMINI-poängen är hög, vilket tyder på cancer, används ytterligare tester som datortomografi och DELFI-testet (som upptäcker förändringar i storleken och fördelningen av cfDNA-fragment över hela genomet) för att bekräfta diagnosen och upptäcka cancerstadiet. Denna kombination av tester har visat sig vara mycket effektiv och över 90% av lungcancerfallen i studien har upptäckts.
Det här är ytterligare en spännande studie som visar på en ny tillämpning av maskininlärning inom medicinsk diagnostik, den här gången för att analysera cancer på cellnivå.
Större kliniska prövningar krävs för att validera verktyget innan det kan bli tillgängligt för klinisk användning.
Den här veckan har en AI-stödd screening av bröstcancer arbetsflöde avsevärt förbättrat hastigheten och effektiviteten i bedömningen av mammogram för cancer.